|
일반적으로 무기산은 유기산보다 더 강산이며, 유기용매보다는 물에 잘 녹는 특성이 있다. 무기산은 물에 녹아서,
수소이온(H+)을 내 놓는다. 다량의 화학물질을 생산할 때, 산이 필요하다면 보통 무기산을 많이 이용한다. 공기 중의
이산화탄소가 물에 녹아 형성되는 탄산, 폭약제조 혹은 로켓 연료의 산화제로 사용되는 질산, 우리 몸의 위에서 방출되는 염산, 콜라에 들어 있는
인산, 간단한 소독약 혹은 바퀴벌레 퇴치용으로도 사용되는 붕산은 모두 무기산이다.
산의 특성은?
수소이온의 개수가 결정한다
산에만 수소이온이 들어 있는 것은 아니다. 순수한 물에도 아주 작은 양의 수소이온이 들어 있다. 따라서 산을 단순히 수용액에 수소이온이
있는 것으로 정의하지 않는다. 순수한 물에 있는 수소이온의 개수보다 더 많은 수소이온을 포함하는 용액을 산성용액이라 부른다. 그러므로 산
용액에 포함된 수소이온의 개수(농도)는 순수한 물에 포함된 수소이온의 개수(농도)보다 훨씬 많다. 물에 존재하는 수소이온은 물 분자와 결합한
형태인 하이드로늄이온(H3O+)으로 표기하기도 한다. 그러므로 물속에서 수소이온과 하이드로늄이온은 같은
화학종이며, 이름과 표기 방식만 다를 뿐이다.
순수한 물은 물 분자들이 서로 반응을 하여 같은 개수의 양이온(하이드로늄이온)과 음이온(수산화이온)이 만들어지므로 물의 자동 이온화
반응(autoionization)이라 부른다. 화학식으로 표현하면 다음과 같다.
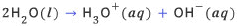
물의 자동 이온화 반응은 매우 적은 수의 물 분자만이 참여하므로, 생성되는 하이드로늄이온과 수산화이온은 매우 적다. 평상시(25℃,
1기압)에 물의 자동 이온화 반응으로 생성되는 두 이온의 농도는 각각 10-7M(몰농도: mol/L)이다. 용액의 산도(acidity)를 표현할 때 사용하는 pH는 -log[H3O+]식에 하이드로늄이온의 농도,
[H3O+]를 대입한 결과 얻어진 숫자를 말한다. 따라서 순수한 물의 자동 이온화 반응으로 형성된
하이드로늄이온의 농도 10-7M을 식에 대입하면 7이 되므로 순수한 물의 pH는 7이라고 말하는 것이다. 그러므로 비교
대상의 용액에서 만약에 pH가 1만큼 차이가 난다면 두 용액에 존재하는 하이드로늄이온의 농도는 10배 차이가 있다는 것이다.
강산과 약산,
무슨 차이가 있을까?
강산과 약산의 차이는 무엇인가? 앞에서 말한 무기산 중에서 붕산을 제외한 염산·질산·황산 등은 강산이다. 그러나 아세트산과 같이
카르복시기를 포함한 유기산 대부분은 약산이며, 설폰산기를 포함하는 유기산은 비교적 강산이다. 강산은 용매에 녹아 있는 모든 산 분자들이
수소이온인 양이온과 수소이온을 제외한 분자의 나머지 부분으로 구성된 음이온으로 분리되는(해리, dissociation) 산을 말한다. 반면에 약산은 많은 산 분자들이 분자의 형태를 그대로 유지하고
일부 분자만 해리되는 산을 말한다. 따라서 강산과 약산의 구분은 산의 농도가 아니라 산 분자의 해리되는 정도로 결정되므로, 농도가 진한 약산
혹은 농도가 묽은 강산도 존재할 수 있다. 예를 들어 강산인 염산 분자(HCl)의 경우에는 물에서 수소이온(H+)과
염소이온(Cl-)으로 거의 100% 해리된다. 그렇지만 약산인 아세트산 분자(CH3COOH)는 일부의
분자만이 수소이온(H+)과 아세트산이온(CH3COO-)으로 해리되며, 나머지는
해리되지 않은 형태로 존재한다.
|



